לא מתכותנקראים יסודות כימיים היוצרים חומרים פשוטים בצורה חופשית, אין להם תכונות פיזיקליות של מתכות. מתוך 109 היסודות הכימיים, ניתן לייחס 87 למתכות, 22 הם לא מתכות.
בתנאים רגילים, לא-מתכות ניתן למצוא ב גזי, נוזלי, ו מצב מוצק.
גזיםהם הליום He, ניאון Ne, ארגון Ar, קריפטון Kr, קסנון Xe, ראדון Rn. זה הכל גזים אינרטיים. כל מולקולת גז אינרטי מורכבת מאטום אחד. ברמה האלקטרונית החיצונית, לאטומים של גזים אינרטיים (למעט הליום) יש שמונה אלקטרונים. להליום יש רק שניים. בשל יציבותם הכימית, ניתן להשוות גזים אינרטיים למתכות יקרות אצילות - זהב ופלטינה, יש להם גם שם אחר - גזים אצילים. שם דומה מתאים יותר לגזים אינרטיים, מכיוון שהם יכולים להיכנס תגובה כימיתויוצרים תרכובות כימיות. ב-1962 נודע שקסנון ופלואור יכולים ליצור תרכובות. מאז, יותר מ-150 תרכובות כימיות של קסנון, קריפטון, ראדון עם פלואור, חמצן, כלור וחנקן ידועות.
הרעיון של הבלעדיות הכימית של גזים אצילים או אינרטיים התברר כלא נכון, לכן, במקום קבוצת האפס הצפויה, גזים אינרטים הוקצו לקבוצה השמינית של המערכת המחזורית.
גזים כמו מימן, חמצן, חנקן, כלור ופלואור יוצרים מולקולות דו-אטומיות, שכבר מוכרות לנו H 2, O 2, N 2, CL 2, F 2.
ניתן לבטא את הרכב החומר באמצעות סימנים כימיים ומתמטיים – נוסחה כימית. כפי שאנו כבר יודעים, ניתן לחשב את המשקל המולקולרי היחסי של חומר (Mr) מהנוסחה הכימית. המסה המולקולרית היחסית של חומר פשוט שווה למכפלת המסה האטומית היחסית במספר האטומים במולקולה, למשל חמצן: O 2
מר (O 2) \u003d Ar (O) 2 \u003d 16 2 = 32
עם זאת, חמצן יכול ליצור חומר אלמנטרי גזי נוסף - אוזון, הרכב מולקולת האוזון כבר כולל שלושה אטומי חמצן. נוסחה כימית O 3 .
היכולת של אטומים של יסוד כימי אחד ליצור כמה חומרים פשוטים נקראת אלוטרופיהוהחומרים הפשוטים האלה - שינויים אלוטרופיים, הם נקראים גם שינויים.
המאפיינים של שינויים אלוטרופיים של היסוד הכימי חמצן: חומרים פשוטים O 2 ואוזון O 3 שונים באופן משמעותי.
לחמצן אין ריח אופייני, בניגוד לאוזון (מכאן הגיע השם אוזון - בתרגום מיוונית, אוזון פירושו "מריח"). ניתן לחוש ארומה דומה בזמן סופת רעמים, הגז נוצר באוויר עקב פריקות חשמליות.
לחמצן אין צבע, בניגוד לאוזון, שניתן להבחין בגוון הסגול החיוור שלו. לאוזון יש תכונות קוטל חיידקים. הוא משמש גם לחיטוי מי שתייה. אוזון יכול להפריע למעבר של קרניים אולטרה סגולות של ספקטרום השמש, הם מזיקים לכל האורגניזמים החיים על פני כדור הארץ. מסך האוזון (שכבת), הנמצא בגובה של 20-35 ק"מ, מגן על כל היצורים החיים מקרני השמש המזיקות.
מ-22 חומרים פשוטים שאינם מתכתייםבתנאים רגילים ב נוזלמצב, רק ברום קיים, המולקולות שלו הן דו-אטומיות. הנוסחה של ברום: Br 2 .
הברום הוא חום כבד ריח רענוזל (ברומוס מהשפה היוונית העתיקה מתורגם כ"מסריח").
מוצקים שאינם מתכתיים כגון גופרית ופחמן ידועים עוד מימי קדם (פחם).
מוצקגם חומרים שאינם מתכת מועדים לתופעת אלוטרופיה. פחמן יכול ליצור חומרים פשוטים כמו יהלום, גרפיט וכו'. ההבדל במבנה של יהלום וגרפיט טמון במבנה של סריגי קריסטל.
יש לך שאלות? לא יודעים איך להכין שיעורי בית?
לקבלת עזרת מורה דרך - הירשמו.
השיעור הראשון חינם!
www.site, עם העתקה מלאה או חלקית של החומר, נדרש קישור למקור.
MNOU "Lyceum"
חיבור על כימיה בנושא:
"לא מתכות"
הושלם:
11 תלמידי כיתה א'
קוצ'רנקו מריה,
שדרינה קסניה.
בָּדוּק:
מורה לכימיה
מרינה שצ'רבקובה
אלכסנדרובנה.
קמרובו - 2002
הקדמה………………………………………………………………………………………..3
§1. מיקומם של יסודות לא מתכתיים במערכת המחזורית של יסודות כימיים. למצוא בטבע. כימיקלים כלליים ו תכונות גשמיות……………………………………4
§2. נפוצים תכונות כימיותלא מתכות………………………..6
§3. המבנה והתכונות של חומרים פשוטים - לא מתכות………7
§4. תרכובות חמצן ומימן של לא מתכות. תיאור קצר של נכסיהם………………………………………………………9
מִבְחָן
רשימת ספרות משומשת
מבוא .
כל המגוון של הטבע סביבנו מורכב משילובים של מספר קטן יחסית של יסודות כימיים.
בתקופות היסטוריות שונות הוכנסו משמעויות שונות למושג "יסוד". פילוסופים יווניים עתיקים החשיבו ארבעה "יסודות" כ"יסודות" - חום, קור, יובש ולחות. בשילוב בזוגות הם יצרו את ארבעת ה"מקורות" של כל הדברים - אש, אוויר, מים ואדמה. בימי הביניים נוספו לעקרונות אלו מלח, גופרית וכספית. במאה ה-17, ר' בויל הצביע על כך שכל היסודות הם בעלי אופי חומרי ומספרם יכול להיות גדול למדי.
בשנת 1787 יצר הכימאי הצרפתי א' לבואזיה את "טבלת הגופים הפשוטים". הוא כלל את כל האלמנטים הידועים באותה תקופה. האחרונים היו מובנים גופים פשוטים, שלא ניתן היה לפרק בשיטות כימיות לפשוטות עוד יותר. לאחר מכן, התברר כי כמה חומרים מורכבים נכללו בטבלה.
נכון להיום, המושג "יסוד כימי" מבוסס במדויק.
יסוד כימי הוא קבוצה של אטומים בעלי אותו מטען חיובי על הגרעין. (זה האחרון שווה למספר הסידורי של היסוד בטבלה המחזורית.)
נכון לעכשיו, ידועים 107 אלמנטים. כ-90 מהם קיימים בטבע. השאר מתקבלים באופן מלאכותי באמצעות תגובות גרעיניות. יסודות 104-107 סונתזו על ידי פיזיקאים במכון המשותף למחקר גרעיני בדובנה. העבודה נמשכת כרגע השגה מלאכותיתיסודות כימיים עם יסודות סידוריים גבוהים יותר.
כל היסודות מחולקים למתכות ולא-מתכות. מתוך 107 היסודות, 85 הם מתכות. אי-מתכות כוללות את היסודות הבאים: הליום, ניאון, ארגון, קריפטון, קסנון, ראדון, פלואור, כלור, ברום, יוד, אסטטין, חמצן, גופרית, סלניום, טלוריום, חנקן, זרחן, ארסן, פחמן, סיליקון, בורון, מֵימָן. עם זאת, חלוקה זו מותנית. בתנאים מסוימים, מתכות מסוימות עשויות להפגין תכונות לא מתכתיות, וחלק לא מתכות עשויות להפגין תכונות מתכתיות.
§1. מיקומם של יסודות לא מתכתיים במערכת המחזורית של יסודות כימיים. למצוא בטבע. תכונות כימיות ופיזיקליות כלליות.
יש יחסית מעט יסודות לא מתכתיים בהשוואה ליסודות מתכתיים. מיקומם במערכת המחזורית של יסודות כימיים D.I. מנדלייב משתקף בטבלה מס' 1.
טבלה מספר 1.
כפי שניתן לראות מטבלה מס' 1, יסודות לא מתכתיים ממוקמים בעיקר בחלק הימני העליון של הטבלה המחזורית. מכיוון שבתקופות משמאל לימין גדלים המטענים של גרעיני אטומי היסודות והרדיוס האטומי פוחת, ובקבוצות מלמעלה למטה גדלים גם הרדיוסים האטומיים, ברור מדוע האלקטרונים החיצוניים מושכים את הלא- אטום מתכת חזק יותר מאטומי המתכת. בהקשר זה, לא-מתכות נשלטות על ידי תכונות חמצון. תכונות חמצון חזקות במיוחד, כלומר. היכולת לצרף אלקטרונים מוצגת על ידי לא-מתכות שנמצאות בתקופות ה-2 וה-3 של קבוצות VI-VII. פלואור הוא חומר החמצון החזק ביותר. בהתאם לערכים המספריים של האלקטרושליליות היחסית, יכולות החמצון של לא-מתכות עולות בסדר הבא: Si, B, H, P, C, S, I, N, Cl, O, F. לכן, פלואור יוצר אינטראקציה נמרצת ביותר עם מימן ומתכות:
חמצן מגיב פחות בעוצמה:
פלואור הוא הלא מתכת האופיינית ביותר, וזה לא אופייני תכונות משקמות, כלומר היכולת לתרום אלקטרונים בתגובות כימיות.
חמצן, אם לשפוט לפי התרכובות שלו עם פלואור, יכול גם להפגין מצב חמצון חיובי, כלומר. להיות משחזר.
כל שאר הלא מתכות מציגות תכונות מפחיתות. יתר על כן, תכונות אלו גדלות בהדרגה מחמצן לסיליקון: O, Cl, N, I, S, C, P, H, B, Si. כך, למשל, כלור אינו מתחבר ישירות עם חמצן, אך ניתן להשיג את התחמוצות שלו בעקיפין (Cl2 O, ClO2, Cl2O2), שבהם הכלור מפגין מצב חמצון חיובי. חנקן בטמפרטורות גבוהות מתחבר ישירות עם חמצן, ולכן, מפגין תכונות מפחיתות. גופרית מגיבה ביתר קלות עם חמצן: היא גם מציגה תכונות חמצון.
הבה נפנה לשיקול המבנה של מולקולות שאינן מתכת. לא-מתכות יוצרות מולקולות מונוטומיות ודיאטומיות כאחד.
לא-מתכות מונוטומיות כוללות גזים אינרטיים שלמעשה אינם מגיבים אפילו עם החומרים הפעילים ביותר. גזים אינרטיים ממוקמים בקבוצה VIII של הטבלה המחזורית, והנוסחאות הכימיות של החומרים הפשוטים המתאימים הם כדלקמן: He, Ne, Ar, Kr, Xe ו-Rn.
חלק לא-מתכות יוצרות מולקולות דו-אטומיות. אלה הם H2, F2, Cl2, Br2, I2 (יסודות מקבוצת VII של המערכת המחזורית), כמו גם חמצן O2 וחנקן N2. גז אוזון (O3) מורכב ממולקולות טריאטומיות.
עבור חומרים שאינם מתכתיים הנמצאים במצב מוצק, די קשה ליצור נוסחה כימית. אטומי הפחמן בגרפיט מחוברים זה לזה בדרכים שונות. קשה לבודד מולקולה בודדת במבנים הנתונים. כאשר כותבים את הנוסחאות הכימיות של חומרים כאלה, כמו במקרה של מתכות, מובאת ההנחה שחומרים כאלה מורכבים רק מאטומים. נוסחאות כימיות, במקרה זה, נכתבות ללא מדדים - C, Si, S וכו'.
חומרים פשוטים כמו אוזון וחמצן, בעלי אותו הרכב איכותי (שניהם מורכבים מאותו יסוד - חמצן), אך שונים במספר האטומים במולקולה, הם בעלי תכונות שונות. לכן, לחמצן אין ריח, בעוד לאוזון יש ריח חריף שאנו מרגישים במהלך סופת רעמים. המאפיינים של לא-מתכות מוצקות, גרפיט ויהלום, שגם להם יש את אותו הרכב איכותי אך מבנה שונה, נבדלות בחדות (גרפיט שביר, יהלום קשה). לפיכך, תכונותיו של חומר נקבעות לא רק על ידי ההרכב האיכותי שלו, אלא גם על ידי כמה אטומים כלולים במולקולת חומר וכיצד הם מחוברים זה לזה.
לא-מתכות בצורה של גופים פשוטים נמצאים במצב מוצק או גזי (למעט ברום - נוזל). אין להם תכונות פיזיקליות של מתכות. לא-מתכות מוצקות אין את הברק האופייני למתכות, הן לרוב שבירות, מוליכות חשמל וחום גרוע (למעט גרפיט).
§2. תכונות כימיות כלליות של לא מתכות.
תחמוצות שאינן מתכת מסווגות כתחמוצות חומציות, המקבילות לחומצות. לא-מתכות יוצרות תרכובות גזיות עם מימן (למשל HCl, H2S, NH3). תמיסות מימיות של חלק מהם (לדוגמה, הלידים מימן) הן חומצות חזקות. עם מתכות, לא מתכות טיפוסיות נותנות תרכובות עם קשרים יוניים (למשל NaCl). לא-מתכות יכולות, בתנאים מסוימים, להגיב זו עם זו וליצור תרכובות עם קשרים קוטביים קוולנטיים (H2O, HCl) ולא-קוטביים (CO2).
לא-מתכות יוצרות תרכובות נדיפות עם מימן, כגון מימן פלואוריד HF, מימן גופרתי H2S, אמוניה NH3, מתאן CH4. בהמסה במים, תרכובות המימן של הלוגנים, גופרית, סלניום וטלוריום יוצרות חומצות בנוסחה זהה לתרכובות המימן עצמן: HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te.
כאשר אמוניה מומסת במים, נוצרים מי אמוניה, המסומנים בדרך כלל בנוסחה NH4OH ונקראים אמוניום הידרוקסיד. זה מסומן גם בנוסחה NH3 H2O והוא נקרא אמוניה הידרט.
עם חמצן, לא-מתכות יוצרות תחמוצות חומציות. בתחמוצות מסוימות, הם מציגים מצב חמצון מרבי השווה למספר הקבוצה (לדוגמה, SO2, N2O5), בעוד שבאחרים, נמוך יותר (לדוגמה, SO2, N2O3). תחמוצות חומצה מתאימות לחומצות, ומשתי חומצות החמצן של אחת שאינה מתכת, זו שבה היא מציגה דרגת חמצון גבוהה יותר חזקה יותר. לדוגמה, חומצה חנקתית HNO3 חזקה יותר מ-HNO2 חנקתית, וחומצה גופרתית H2SO4 חזקה יותר מגופרית H2SO3.
§3. המבנה והתכונות של חומרים פשוטים - לא מתכות.
לא-מתכות האופייניות ביותר יש מבנה מולקולרי, בעוד שלפחות אופייניות יש מבנה לא מולקולרי. זה מסביר את ההבדל בתכונות שלהם. זה מוצג בבירור באיור 2.
טבלה מספר 2
לבורון B גבישי (כמו סיליקון גבישי) יש נקודת התכה גבוהה מאוד (2075 מעלות צלזיוס) וקשיות גבוהה. המוליכות החשמלית של בורון עולה מאוד עם עליית הטמפרטורה, מה שמאפשר להשתמש בו באופן נרחב בטכנולוגיית מוליכים למחצה. הוספת בורון לפלדה וסגסוגות של אלומיניום, נחושת, ניקל וכו' משפרת את תכונותיהם המכניות.
בורידים (תרכובות של בורון עם מתכות מסוימות, כגון טיטניום: TiB, TiB2) נחוצים בייצור חלקי מנועי סילון, להבי טורבינת גז.
כפי שניתן לראות מתכנית מס' 2, לפחמן C, סיליקון Si, בורון B יש מבנה דומה ויש להם כמה מאפיינים משותפים. כחומרים פשוטים, הם מתרחשים בשני שינויים - גבישי ואמורפי. השינויים הגבישיים של אלמנטים אלה קשים מאוד, עם טמפרטורה גבוהההַתָכָה. לסיליקון גבישי יש תכונות מוליכים למחצה.
כל היסודות הללו יוצרים תרכובות עם מתכות - קרבידים, סיליקידים ובורידים (CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2). לחלקם יש קשיות גבוהה יותר, כגון Fe3C, TiB. סידן קרביד משמש לייצור אצטילן.
אם נשווה את סידור האלקטרונים באורביטלים של אטומים של פלואור, כלור והלוגנים אחרים, נוכל גם לשפוט את תכונותיהם הייחודיות. לאטום הפלואור אין אורביטלים חופשיים. לכן, אטומי פלואור יכולים להראות רק ערכיות I ומצב חמצון - 1. באטומים של הלוגנים אחרים, למשל, באטום הכלור, ישנם ד-אורביטלים חופשיים באותה רמת אנרגיה. בשל כך, התכלות של אלקטרונים יכולה להתרחש בשלוש דרכים שונות.
במקרה הראשון, כלור יכול להראות מצב חמצון של +3 וליצור חומצה הידרוכלורית HClO2, המתאימה למלחים - כלוריטים, למשל, אשלגן כלוריט KClO2.
במקרה השני, כלור יכול ליצור תרכובות שבהן מצב החמצון של הכלור הוא +5. תרכובות אלו כוללות חומצה כלורונית HClO3 ומלחיה - כלורטים, למשל, אשלגן כלורט KClO3 (מלח ברטולט).
במקרה השלישי, כלור מפגין מצב חמצון של +7, למשל, בחומצה פרכלורית HClO4 ובמלחים שלה - פרכלורטים, למשל, באשלגן פרכלורט KClO4.
§4. תרכובות חמצן ומימן של לא מתכות. תיאור קצר של המאפיינים שלהם.
עם חמצן, לא-מתכות יוצרות תחמוצות חומציות. בתחמוצות מסוימות, הם מציגים מצב חמצון מרבי השווה למספר הקבוצה (לדוגמה, SO2, N2O5), בעוד שבאחרים, נמוך יותר (לדוגמה, SO2, N2O3). תחמוצות חומצה מתאימות לחומצות, ומשתי חומצות החמצן של אחת שאינה מתכת, זו שבה היא מציגה דרגת חמצון גבוהה יותר חזקה יותר. לדוגמה, חומצה חנקתית HNO3 חזקה יותר מ-HNO2 חנקתית, וחומצה גופרתית H2SO4 חזקה יותר מגופרית H2SO3.
מאפיינים תרכובות חמצן של לא מתכות:
1. נכסים תחמוצות גבוהות יותר(כלומר תחמוצות, הכוללות יסוד מקבוצה זו עם מצב החמצון הגבוה ביותר) בתקופות משמאל לימין משתנות בהדרגה מבסיסי לחומצי.
2. בקבוצות מלמעלה למטה, התכונות החומציות של תחמוצות גבוהות יותר נחלשות בהדרגה. ניתן לשפוט זאת לפי תכונות החומצות המתאימות לתחמוצות אלו.
3. העלייה בתכונות החומציות של התחמוצות הגבוהות יותר של היסודות המקבילים בתקופות משמאל לימין מוסברת על ידי עליה הדרגתית במטען החיובי של יונים של יסודות אלה.
4. בתת הקבוצות העיקריות של המערכת המחזורית של יסודות כימיים בכיוון מלמעלה למטה, התכונות החומציות של תחמוצות גבוהות יותר של לא מתכות פוחתות.
הנוסחאות הכלליות של תרכובות מימן לפי קבוצות המערכת המחזורית של יסודות כימיים ניתנות בטבלה מס' 3.
טבלה מספר 3.
עם מתכות, מימן יוצר (עם כמה יוצאי דופן) תרכובות לא נדיפות, שהן מוצקים לא מולקולריים. לכן, נקודות ההיתוך שלהם גבוהות יחסית.
עם לא-מתכות, מימן יוצר תרכובות נדיפות בעלות מבנה מולקולרי. בתנאים רגילים מדובר בגזים או נוזלים נדיפים.
בתקופות משמאל לימין, התכונות החומציות של תרכובות מימן נדיפות של לא-מתכות בתמיסות מימיות משתפרות. זה נובע מהעובדה שליוני חמצן יש זוגות אלקטרונים חופשיים, וליוני מימן יש מסלול חופשי, אז מתרחש תהליך שנראה כך:
H2O + HF - H3O + F
מימן פלואוריד בתמיסה מימית מפצל יוני מימן חיוביים, כלומר. מפגין תכונות חומציות. לתהליך זה תורמת גם נסיבה נוספת: ליון החמצן יש זוג אלקטרונים לא משותף, וליון המימן יש אורביטל חופשי, שבגללו נוצר קשר תורם-מקבל.
כאשר אמוניה מומסת במים, מתרחש תהליך הפוך. ומכיוון שליוני חנקן יש זוג אלקטרונים לא משותף, וליוני מימן יש אורביטל חופשי, נוצר קשר נוסף ונוצרים יוני אמוניום NH4 + ויוני הידרוקסיד OH-. כתוצאה מכך, הפתרון רוכש תכונות בסיסיות. תהליך זה יכול לבוא לידי ביטוי בנוסחה:
H2O + NH3- NH4 + OH
מולקולות אמוניה בתמיסה מימית מוסיפות יוני מימן חיוביים, כלומר. אמוניה מציגה תכונות בסיסיות.
עכשיו תחשבו מדוע תרכובת המימן של הפלואור - מימן פלואוריד HF - בתמיסה מימית היא חומצה, אך חלשה יותר מחומצה הידרוכלורית. זאת בשל העובדה שרדיוסים של יוני פלואור קטנים בהרבה מאלה של יוני כלור. לכן, יוני פלואור מושכים יוני מימן בצורה חזקה הרבה יותר מאשר יוני כלוריד. בהקשר זה, מידת הניתוק של חומצה הידרופלואורית קטנה בהרבה מזו של חומצה הידרוכלורית, כלומר. חומצה הידרוכלורית חלשה יותר מחומצה הידרוכלורית.
מהדוגמאות שניתנו, ניתן לעשות את הדברים הבאים מסקנות כלליות:
1. בתקופות משמאל לימין עולה המטען החיובי של יוני היסודות. בהקשר זה, התכונות החומציות של תרכובות מימן נדיפות של יסודות בתמיסות מימיות משופרות.
2. בקבוצות, מלמעלה למטה, אניונים בעלי מטען שלילי מושכים יותר ויותר יוני מימן בעלי מטען חיובי חלש H+. בהקשר זה, תהליך הפיצול של יוני מימן H+ מקל והתכונות החומציות של תרכובות מימן מתגברות.
3. תרכובות מימן של לא מתכות, בעלות תכונות חומציות בתמיסות מימיות, מגיבות עם אלקליות. תרכובות מימן של לא מתכות, בעלות תכונות בסיסיות בתמיסות מימיות, מגיבות עם חומצות.
4. פעילות החמצון של תרכובות מימן של לא מתכות בקבוצות מלמעלה למטה עולה מאוד. כך למשל, אי אפשר לחמצן את הפלואור מתרכובת המימן HF בצורה כימית, אך ניתן לחמצן כלור מתרכובת המימן HCl על ידי חומרי חמצון שונים. זה מוסבר על ידי העובדה שרדיוסים אטומיים גדלים בחדות מלמעלה למטה בקבוצות, שבקשר אליהן מקל על החזרת האלקטרונים.
רשימת ספרות משומשת.
1. Rudzitis G.E., Feldman F.G. כימיה-11 - מ.: חינוך, 1992.
2. Kremenchugskaya M., Vasiliev S. Children's Handbook - M.: AST, 1999.
3. חומצ'נקו ג.פ. כימיה למועמדים לאוניברסיטאות - M .: Higher School, 1993.
לא מתכות, יסודות כימיים שאין להם את התכונות האופייניות למתכות. לא-מתכות הם בדרך כלל מוליכים גרועים של חום וחשמל (הם בדרך כלל מבודדים של חום וחשמל). אי מתכות כוללות פחמן, ... ... מילון אנציקלופדי מדעי וטכני
יסודות כימיים, היוצרים גופים פשוטים שאין להם את התכונות האופייניות למתכות. לא מתכות כוללות בדרך כלל 22 יסודות: גזים מימן, חנקן, חמצן, פלואור, כלור וגזים אצילים; ברום נוזלי; בורון גופים מוצקים, ... ... מילון אנציקלופדי גדול
ללא מתכות- כימיה יסודות שנוצרים במצב חופשי חומרים פשוטים שאין להם פיזיקליים. ו-chem. מאפיינים (ראה); שם מיושן עבור מטאלואיד. נהוג להתייחס ל-N. 22 יסודות של הטבלה המחזורית של היסודות של D. I. Mendeleev (ראה): מימן ... האנציקלופדיה הפוליטכנית הגדולה
יסודות כימיים היוצרים גופים פשוטים שאין להם את התכונות האופייניות למתכות. לא מתכות כוללות בדרך כלל 22 יסודות: גזים מימן, חנקן, חמצן, פלואור, כלור וגזים אצילים; ברום נוזלי; בורון גופים מוצקים, ... ... מילון אנציקלופדי
לא מתכות- יסודות כימיים היוצרים גופים פשוטים שאין להם את התכונות האופייניות למתכות. לא-מתכות כוללות 22 יסודות. מתוכם, בטמפרטורת החדר נמצאים במצב גזי H, N, O, F, Cl ... מילון אנציקלופדיות למטלורגיה
יסודות כימיים היוצרים גופים פשוטים שאין להם את התכונות האופייניות למתכות (ראה מתכות). השם מטאלואידים, המשמש לעתים ל-N., הולך ואינו שימוש. נ' כולל 22 אלמנטים. מתוכם, עם ...... האנציקלופדיה הסובייטית הגדולה
פשוט ב-va, לא מחזיק את המתכות שלך. למרות שאי אפשר למתוח קו חד בין מתכות לחנקן, גזים אצילים, מימן, הלוגנים, חמצן, כולקוגנים, חנקן, זרחן, ארסן, פחמן, סיליקון ובורון מכונים בדרך כלל חנקן. מילון פוליטכני אנציקלופדי גדול
Chem. יסודות היוצרים גופים פשוטים שאין להם את התכונות האופייניות למתכות. ל-N נושאים בדרך כלל 22 יסודות: גזים מימן, חנקן, חמצן, פלואור, כלור וגזים אצילים; ברום נוזלי; טֵלֶוִיזִיָה. גופים בורון, פחמן, סיליקון, זרחן, ... ... מדע טבעי. מילון אנציקלופדי
ללא מתכות- חומרים פשוטים שאין להם תכונות של מתכות: אין להם ברק מתכתי, לא מחשלים, מוליכים בצורה גרועה חום וחשמל. אין גבול חד בין לא-מתכות למתכות. לא-מתכות כוללות 22 יסודות. מתוכם, תחת רגיל ...... מילון מתכות
כימיה אנאורגנית היא ענף בכימיה הקשור לחקר המבנה, התגובתיות והתכונות של כל היסודות הכימיים והתרכובות האנאורגניות שלהם. אזור זה מכסה את כל התרכובות הכימיות, למעט אורגניות ... ... ויקיפדיה
ספרים
- סט שולחנות. כִּימִיָה. לא מתכות (18 טבלאות), . אלבום חינוכי של 18 גיליונות. אומנות. 5-8688-018 הלוגנים. כימיה של הלוגנים. גוֹפרִית. אלוטרופיה. כימיה של גופרית. חומצה גופרתית. כימיה של חנקן. תחמוצות חנקן. חומצה חנקתית היא חומר מחמצן. זַרחָן.…
- כִּימִיָה. מתכות. לא מתכות. כיתה 9 חוברת עבודה, קורושצ'נקו אנטונינה סטפנובנה. חוברת עבודהמכיל מספר רב של משימות שניתן להשתמש בהן להשגת נושא, מטא-נושא ותוצאות אישיות של הוראת כימיה בכיתה ט'. תועלת…
- מבחני כימיה: 9 תאים. : לא מתכות. הכללת ידע בכימיה לקורס בית הספר היסודי. הכנה לבחינת המדינה הבסיסית. תקן חינוכי של המדינה הפדרלית, ריאבוב, מיכאיל אלכסייביץ'. מדריך זה תואם באופן מלא לתקן החינוכי של המדינה הפדרלית (דור שני). המדריך כולל מבחנים המכסים שני נושאים של ספר הלימוד מאת O.S. Gabrielyan ...
בין חומרים פשוטים, חלקם נבדלים במספר תכונות נפוצות. יש להם ברק אופייני, גמישות, מוליכים זרם חשמלי היטב. חומרים פשוטים כאלה נקראים מתכות(איור 11.3), והיסודות הכימיים המתאימים - אלמנטים מתכתיים. לכל המתכות מבנה לא מולקולרי. אחת המתכות החשובות ביותר היא ברזל.
שולחן. כמה מתכות, מוצרים מהם ואזכור בספרות
|
Auחזה מוזהב (פירוט) |
השאגה שככה, והזוהר נמוג, רק זהב זורח עם השמש, הרוח שורקת מעל הערבה הכחולה שמו של הסקיתי מהלל. בוריס מוזולבסקי.ערבה חרמשית |
|
אלמוצרי אלומיניום  |
הפסל "ארוס" בכיכר פיקדילי בלונדון, בריטניה הוא אחד הפסלים הראשונים בייצורו ששימש אלומיניום. |
|
Cuשבשבת מזג אוויר נחושת  |
נחושת, כמו זהב, שונה ממתכות אחרות בצבע האופייני לה. ומכתש נחושת, נחושת אדומה, רק העלי נשבר... איבן קרפנקו קארי.מאה אלף אז אמו של סביאטוסלב, הנסיכה אולגה, ניגשה לסביאטוסלב, היא החזיקה בידיה עבודה שנעשתה על ידי מיטב הנפחים מנחושת אדומה, מוזהבת, מעוטרת ברבים. אבנים יקרותקַסדָה. סמיון סקליארנקו.סביאטוסלב |
|
hgכספית בתנאים סטנדרטיים (ט\u003d 25 ° С, P \u003d 1 atm) - נוזל  |
ובמשך כמה סאז'נים מסביב לסירה, נפוח מת כבד, חסר תנועה, כמו כספית, היה כסף עמום. צ'ינגיז אייטמטוב.כלב חלוק רץ לאורך שפת הים |
|
א.גמטבעות כסף  |
אַשְׁרֵי הָאָדָם שֶׁזָּכֶה בְּחָכְמָה, וְהָאָדָם שֶׁהָיָה בְּבָנָה, כִּי טוֹב זֶה מֵהַכֶּסֶף. איבן אוהיינקו.כִּתבֵי הַקוֹדֶשׁ |
|
Znכלי שולחן מגולוונים  |
אוי, כמה, כמה שלוליות מאי - שאריות אבץ כחול! ואסילי קאזין.עובד במאי הבריכה מרופדת באבץ לאורך השוליים, ופעם בשבוע מסירים את האבץ הזה, מובילים אותו למטבח, שם מקרצפים אותו לברק. ג'רום ק. ג'רום.שלושה על אופניים / תרגום א. פופוב |
לא מתכותתכונות האופייניות למתכות אינן טבועות. עם זאת, אין גבול ברור בין קבוצות החומרים הללו.חומר מהאתר
לדוגמה, סִילִיקוֹן- לא מתכת. עם זאת, במראה קל לבלבל אותו עם מתכת. סיליקון נמצא בשימוש נרחב כחומר לייצור התקני מוליכים למחצה, פרוסות למערכות אנרגיה סולארית. גרפיט לא מתכתי, כמו מתכות, מוליך חשמל.
לא מתכות מתאימות לא מתכתי כִּימִי אלמנטים.
פחמן, גופרית, זרחן, חמצן, חנקן, כלור, ברום ויוד מסווגים כלא-מתכות. כלור הוא גז. ברום הוא נוזל נדיף. גבישי יוד יש צבע אופייניוברק, שהופכים אותו לדומה במקצת למתכות. כאשר מחומם, יוד יוצר אדים סגולים.
לא-מתכות מורכבות בעיקר ממולקולות. למרות זאת יהלום(חומר פחמן פשוט) ו סִילִיקוֹן- חומרים בעלי מבנה אטומי.
שמות המתכות והלא-מתכות הם שמות עצם נפוצים, לא שלהם.
איך לברר מהטבלה המחזורית האם יסוד כימי הוא מתכתי או לא מתכתי? יש הרבה פחות יסודות לא מתכתיים. בעיקר, הם ממוקמים בצד ימין של הטבלה המחזורית. התאים שלהם מסומנים בקווים מודגשים.
בעמוד זה חומר בנושאים:
כימיה לרמות גיליון מתכות ולא מתכות
הודעה על מתכות ולא מתכות
דוח כימיה של מתכות ולא מתכות
דו"ח בית ספר - לא מתכות
מה זה מתכת ולא מתכת gdz
שאלות לגבי פריט זה:
עיון בפסקה יעזור לך:
לתת דוגמאות לחומרים פשוטים של מתכות ולא מתכות;
להבחין בין מתכות ללא מתכות, יסודות מתכתיים ולא מתכתיים;
· להשתמש במערכת המחזורית כהתייחסות לקביעת המיקום של כמה יסודות כימיים לא מתכתיים ומתכתיים בה.
אילו חומרים למזוג לפשוט? תכונה של כל מדע היא שהאובייקטים הנחקרים כפופים לסיווג. מדע הכימיה אינו יוצא מן הכלל, מכיוון שלא ניתן לחקור חומרים ללא סיווג מתאים.
על פי ההרכב האיכותי, חומרים מחולקים לפשוטים ומורכבים.
חומרים פשוטיםהם חומרים הנוצרים על ידי אטומים של יסוד כימי אחד
ברשימת הנוסחאות לעיל: Fe, O 2, H 2 O, NaHCO 3, NaCl, H 2 SO 4, N 2, Al 2 O 3, Al, O 3 אנו מוצאים את הנוסחאות של חומרים פשוטים. באמצעות ההגדרה שלעיל של חומרים פשוטים, אנו מסיקים שאלו יהיו הנוסחאות: Fe, O 2, N 2, Al, B 3. נוסחאות אחרות נוצרות מאטומים של יסודות כימיים שונים. כפי שאתה יודע ממדעי הטבע, מדובר בחומרים מורכבים.
אטומים של יסוד כימי אחד יכולים ליצור כמה חומרים פשוטים. לדוגמה, אטומי חמצן O 2 ואוזון מורכבים מאטומי חמצן; הנוסחאות הכימיות שלהם שונות במספר אטומי החמצן. זה בדיוק מה שמוצג באיור 55.
אורז. 55. מודלים של מולקולות חמצן (א) ואוזון (6)
* הפרדה של משהו לפי קריטריונים מסוימים.

אורז. 56. יהלום (א) וגרפיט (ג) ודגמי המבנה שלהם (6. ד)
אטומי פחמן יצרו את החומר הטבעי הקשה ביותר יהלום, וכל כך רך עד שהוא משאיר כתובות על נייר - גרפיט. הנוסחאות הכימיות של חומרים אלו כתובות באותו אופן - C. הבדלים בתכונות של גרפיט יהלום אינם נובעים מהרכב כמותי או איכותי שונה, אלא מסידור מרחבי שונה של אטומי פחמן בחומר זה ביחס לזה (איור 1). 56). בגרפיט מניחים אותם בשכבות, והמרחקים בין אטומים בתוך שכבה אחת פחותים בהרבה מאשר בין שכבות סמוכות (איור 56ד) לכן, מספיק ללחוץ קלות על העיפרון והשלמות בין השכבות מופרת. ביהלום, אטומי פחמן מסודרים כך שהם נמצאים במרחק זהה זה מזה, והקשרים ביניהם מכוונים לקודקודי הטטרהדרון (איור 56ב). זה גורם לקשיות גבוהה של החומר.
למרות הדוגמאות שניתנו, חשבו מה יותר - יסודות כימיים או חומרים פשוטים.
על פי המינוח הכימי האוקראיני המודרני, שמותיהם של כמה חומרים פשוטים אינם תואמים את שמות היסודות הכימיים שמהם הם נוצרו. הטבלה מציגה דוגמאות לחומרים כאלה. הכירו אותם.
מצאו בטבלה ורשמו במחברת את השמות והנוסחאות של חומרים פשוטים. שבו המולקולה נוצרת על ידי שני אטומים או יותר.
טבלה 4
נוסחאות ושמות של חומרים פשוטים
|
חומר פשוט |
שם הכימיקל אֵלֵמֶנט |
חומר פשוט |
שם הכימיקל אֵלֵמֶנט |
||
|
שֵׁם |
שֵׁם |
||||
|
ארגנטום |
|||||
|
חַמצָן |
|||||
|
כַּספִּית |
גרפיט, יהלום |
||||
הערה! שמות של חומרים פשוטים כתובים באות קטנה, שמות של יסודות כימיים - באות גדולה.
מתכות ולא מתכות. חומרים פשוטים מחולקים למתכות ולא-מתכות. מתכות כוללות אבץ Zn, אשלגן K, סידן Ca, מגנזיום Mg, פח Sn, עופרת Pb, נחושת Cu, ברזל Fe, אלומיניום Al, כסף Ag, זהב Au ואחרים (איור 57).
דוגמאות לא-מתכות הן מימן H 2 חמצן O 2 ואוזון O 3, חנקן N 2, הליום He, neon Ne, argon Ag, פחמן C (מציאות משותפת כזו מיושמת על כל החומרים הפשוטים של פחמן), גופרית S, זרחן P, כלור Cl 2, יוד I 2 ואחרים (איור 58).
בין היסודות הכימיים, מתכתיים שולטים. מבין היסודות הכימיים המוכרים כיום, רק 22 אינם מתכתיים.
בסעיפים 6 ו-7 נבחנו התכונות הפיזיקליות העיקריות של חומרים. בהתמקדות בכך, נרכיב את המאפיינים של חומרים פשוטים של מתכות ולא-מתכות.
התכונות הנפוצות של כל המתכות הן מוליכות תרמית וחשמלית גבוהה; אפור, אפור כסוף (דוגמאות לחריגים: זהב - צהוב, נחושת - אדום לבנים); חוסר ריח; פלסטיות - קל לזייף אותם, לצייר אותם לחוט, לגלגל ליריעות. כל המתכות בטמפרטורת החדר נמצאות במצב צבירה מוצק, למעט כספית (נוזל).
תכונות אלו אינן אופייניות לא-מתכות. לכן, אנחנו יכולים לומר עליהם שהם חומרים פשוטים שאין להם תכונות מתכתיות. אז, לא-מתכות אינן מוליכות או מוליכות בצורה גרועה חום וזרם חשמלי, הן שבירות ולא רקיעות. מימן, חמצן, חנקן, פלואור, כלור, הליום, ארגון ואחרים בטמפרטורת החדר נמצאים במצב צבירה גזי. זרחן, פחמן, גופרית, יוד הם מוצקים, ברום הוא נוזל. ללא מתכות יש יותר הבדלי צבע מאשר למתכות. אז חמצן ומימן חסרי צבע, גופרית צהובה, כלור צהוב-ירוק, ברום חום כהה.
אורז. 57. דוגמאות של מתכות: א - אבץ; b - אלומיניום, c - ברזל, ד - נחושת

אורז. 58. דוגמאות של לא-מתכות: א - יוד, גופרית, ג - זרחן, ד - כלור
יש להדגיש שחלוקה של חומרים פשוטים רק לפי תכונות פיזיקליות למתכות ולא-מתכות אינה מדויקת. למשל, ליוד שאינו מתכתי יש ברק מתכתי, וגרפיט שאינו מתכתי מאופיין במוליכות חשמלית גבוהה. בשיעורים הבאים תרחיב את הידע שלך בחלוקה של חומרים פשוטים למתכות ולא-מתכות על סמך הבדלים במבנה האטומים ובתכונות הכימיות שלהם.
מיקום של אלמנטים מתכתיים ולא מתכתיים במערכת התקופתית. יסודות כימיים, שהאטומים שלהם נוצרים מחומרים פשוטים - מתכות, נקראים מתכתיים, ויסודות כימיים, שהאטומים שלהם נוצרים מחומרים פשוטים - שאינם מתכות - שאינם מתכתיים.
בסעיף 12, הכרת לראשונה את הטבלה המחזורית של יסודות כימיים. עכשיו אתה יודע שהיסודות הכימיים מסודרים במטען הולך וגובר של גרעיני האטומים, ושתא אחד מוקצה תמיד לכל יסוד. האם יש סדירות במיקום של יסודות מתכתיים ולא מתכתיים במערכת המחזורית? כדי לענות על שאלה זו, הבה נעבוד עם הטבלה. בואו נבחר לשיקול את התקופה הראשונה, השנייה והשלישית. בתקופה הראשונה, אין יסודות מתכתיים. התקופה השנייה מתחילה עם היסוד המתכתי Li. גם היסוד הבא, בריליום בי, שייך למתכתיים. המרכיבים הנותרים של תקופה זו אינם מתכת.
התקופה השלישית מתחילה גם ביסוד המתכת Sodium Na, ולאחר מכן מניחים שני יסודות מתכת נוספים - Magnesium Mg ואלומיניום Al. יתר על כן, כמו בתקופה השנייה, ממוקמים אלמנטים לא מתכתיים.
קראו בקול את שמות היסודות של התקופות ה-1, ה-2 וה-3.
אלמנטים מתכתיים ולא מתכתיים ממוקמים באופן שונה במקצת בעמודות האנכיות של הטבלה - קבוצות, ממוספרות בספרות רומיות מ-i עד VIII. אז, כל התאים של קבוצות I ו- II (למעט הראשון בקבוצה) מלאים ביסודות מתכת. יסודות לא מתכתיים ממוקמים בתחילת הקבוצות הנותרות, ואלמנטים מתכתיים בסוף.
מצא עם המורה וקרא בקול את השמות של יסודות לא מתכתיים שמתחילים קבוצות III-VIII.
הדוגמאות הנחשבות ממחישות חוק כללימיקום של יסודות מתכתיים ולא מתכתיים בתקופות ובקבוצות של המערכת המחזורית:
יסודות מתכתיים ממוקמים במערכת המחזורית של יסודות כימיים של D. I. מנדלייב בתחילת תקופות ובסוף קבוצות, ולא מתכתיים - בסוף תקופות ובתחילת קבוצות.
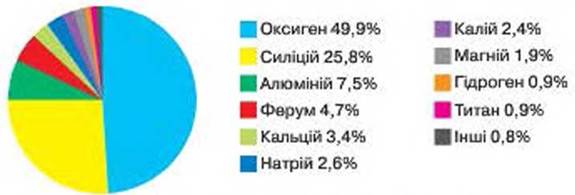
אורז. 59. התפלגות יסודות כימיים על פני כדור הארץ (במסה)
הפצת אלמנטים בטבע. למרות שכ-90 יסודות כימיים נמצאים בטבע בהרכבם של חומרים שונים, הם מתפזרים בצורה לא אחידה. יש אלמנטים מובילים, ויש כאלה שהתוכן שלהם מאוד קטן.
לפי איור. 59 גלה שלושה יסודות מתכתיים ושלושה יסודות לא מתכתיים הם הנפוצים ביותר על פני כדור הארץ. האם יסודות כימיים מתכתיים או לא מתכתיים שולטים בהרכב החומרים על פני כדור הארץ?
בנק חזירון מלומד
בין החומרים הפשוטים יש "אלופים" של תכונות פיזיקליות שונות. אז, ליהלום יש את הקשיות הגבוהה ביותר, מתכת טונגסטן היא עקשן ביותר. ליתיום היא המתכת הקלה ביותר ומימן היא הלא-מתכת הקלה ביותר. מבין המתכות, לכסף, נחושת ואלומיניום יש את המוליכות התרמית הגבוהה ביותר. ביסמוט וכספית יש מוליכות תרמית נמוכה. קיימים מתכות רכות, שניתן לחתוך בסכין, למשל, נתרן, אשלגן, סידן וכרום הם בעלי הקשיות הגבוהה ביותר מבין המתכות - הם יכולים לחתוך זכוכית. משיכות גבוהה בזהב. זה מאפשר להפיק ממנו סרט בעובי של 0.003 מ"מ בלבד.
1. אילו חומרים נקראים פשוטים? תן דוגמאות.
2. לאילו קבוצות מחלקים חומרים פשוטים? לאיזו קבוצה יש יותר נציגים?
3. ציין את התכונות הפיזיקליות הכלליות של מתכות.
4. מה אתה יודע על סידור היסודות המתכתיים והלא מתכתיים בטבלה המחזורית?
5. איזה יסוד מתכת מתחיל את התקופה הרביעית?
6. איזה יסוד שאינו מתכת מתחיל את קבוצת V?
7. ציין שלושה יסודות כימיים לא מתכתיים ומתכתיים הנפוצים בכדור הארץ.
8. מרשימת היסודות הכימיים, בחרו אלה שאינם מתכתיים וסדרו אותם בסדר המסה האטומית היחסית הגדלה: מגנזיום, חמצן, מימן, ברזל, חנקן, כלור.
9. בעזרת הטבלה המחזורית של היסודות הכימיים, שמות את היסוד הכימי שנמצא בתקופה השלישית ואת קבוצת ה- VIII. האם הוא שייך ליסודות מתכתיים או לא מתכתיים? כמה פרוטונים ואלקטרונים יש באטום שלו?
10. מלאו את הפערים במשפטים במילים "מתכת", "לא מתכת" ובשמות היסודות התואמים. התקופה השנייה של הטבלה המחזורית מתחילה ב-_________ יסוד _________, ומסתיימת ב-________ יסוד ___________.
הקבוצה השישית של המערכת המחזורית מתחילה ביסוד _________ ומסתיימת ביסוד _________,
11. ציין כמה שיותר סימנים, לפיהם מסתיימות רשימות החומרים הפשוטים:
א) חמצן, חנקן, מימן;
6) כסף, ברזל, אלומיניום?
השלימו פרויקט בנושא "יסודות כימיים בהרכבם של גרמי שמיים שונים".









